Alltagsrelevante Redoxreaktionen
Zunächst mal die Gliederung meiner Arbeit:
- Redoxreaktionen
1. Begriffsklärung
2. Redoxreaktionen in der Geschichte
3. Ablauf einer Redoxreaktion - Die Verbrennung
1. Vorraussetzungen
2. Verlauf
3. Arten der Verbrennung
4. Beispiel Korrosion - Der Hochofenprozess
1. Aufbau und Ablauf
2. chemischer Vorgang - Zusammenfassung
Begriffsklärung
Wie wir bereits wissen ist die Reduktions-Oxidations-Reaktion, oder kurz Redoxreaktion, ein chemischer Vorgang bei dem Elektronen übertragen werden.
| Oxidation | ist ein Vorgang, bei dem Elektronen abgegeben werden. Der oxidierte Stoff besitzt eine höhere Oxidationsstufe (höhere Oxidationszahl) |
| Reduktion | ist ein Vorgang, bei dem Elektronen aufgenommen werden. Der reduzierte Stoff besitzt eine niedrigere Oxidationsstufe (niedrigere Oxidationszahl) |
| Oxidationsmittel | ist derjenige Stoff, der beim betrachteten Prozeß Elektronen aufnimmt, somit die Oxidation ermöglicht. Das Oxidationsmittel wird dabei reduziert. |
| Reduktionsmittel | ist derjenige Stoff, der beim betrachteten Prozess Elektronen abgibt, somit die Reduktion ermöglicht. Das Reduktionsmittel wird dabei oxidiert. |
| Redoxvorgang | Elektronenabgabe und Elektronenaufnahme sind miteinander gekoppelt und laufen gleichzeitig ab. Daher die Bezeichnung Redox (Red = Reduktion, ox = Oxidation) |
| Oxidationszahlen | geben über den jeweiligen „Oxidationszustand“ eines Stoffes (inwieweit der Stoff bereits oxidiert bzw reduziert wurde) Auskunft. Sie stellen tatsächliche oder angenommene Ladungen dar. |
Um Redoxreaktionen aufstellen zu können spielen die Oxidationszahlen eine große Rolle. Wir haben bereits einige Hilfen zum Erstellen von Oxidationszahlen erhalten, es gibt aber desweiteren noch bestimmte Regeln zur Bestimmung.
- In einer Verbindung erhält stets der elektronegativere Partner die niedrigere und der elektropositivere Partner die höhere Oxidationszahl zugeordnet.
- Elemente im Grundzustand (Atom, Molekül) haben stets die Oxidationszahl 0
- Bestimmte Elemente erhalten aufgrund ihrer Stellung im Periodensystem (hohe oder niedrige Elektronegativität) feststehende Oxidationszahlen zugeordnet.
- Bei einatomigen Ionen stimmen Ionenladung und Oxidationszahl überein.
- Bei mehratomigen Ionen ist die Summe der Oxidationsuahlen der beteiligten Elemente gleich der Ionenladung.
Redoxreaktionen in der Geschichte
Ursprünglich galten als Redoxreaktionen nur solche, bei den das Element Sauerstoff auf einen anderen Reaktionspartner übertragen wurde (Oxidation). Unter der Reduktion verstand man es aus einem Metalloxid das Metall zu gewinnen.
Auch die Herkunft dieser Wörter leiten sich unmittelbar aus dieser Definition ab. Allerdings schließt die heutige Definition die alten ein und erweitern sie. Da beide Vorgänge miteinander gekoppelt sind und gleichzeitig ablaufen.
Ablauf einer Redoxreaktion
Bei jeder Redoxreaktion reagiert ein Stoff A, der Elektronen abgibt (Reduktionsmittel, auch Donator genannt) mit mindestens einem Stoff B, der diese Elektronen aufnimmt (Oxidationsmittel, auch Akzeptor genannt).
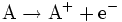 |
Oxidation: Stoff A gibt als Reduktionsmittel ein Elektron ab. |
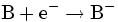 |
Reduktion: Das Elektron wird vom Oxidationsmittel B aufgenommen. |
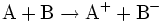 |
Redoxreaktion: Stoff A gibt ein Elektron an Stoff B ab. |